Già Theo Đợt

Những đợt bùng nổ nhanh chóng trong quá trình lão hóa đang khiến chúng ta phải suy nghĩ lại hoàn toàn về cách chúng ta già đi
Tóm tắt:
Bài viết thảo luận về một quan điểm mới về lão hóa, cho rằng đây không phải là một quá trình suy giảm tuyến tính mà là những đợt lão hóa nhanh chóng xảy ra ở các độ tuổi cụ thể, khoảng 34, 60 và 78. Những điểm bùng phát này được đánh dấu bằng những thay đổi phân tử đáng kể, ảnh hưởng đến khả năng chuyển hóa, chức năng miễn dịch và sức khỏe tổng thể . Việc nhận diện những giai đoạn dễ tổn thương này có thể mở ra hướng tiếp cận mới trong việc làm chậm quá trình lão hóa, thay vì chỉ tìm kiếm một loại thuốc chống lão hóa phổ quát.
Những đợt bùng nổ nhanh chóng trong quá trình lão hóa đang khiến chúng ta phải suy nghĩ lại hoàn toàn về cách chúng ta già đi
Chắc hẳn bạn đã từng có cảm giác bỗng nhiên thấy mình già đi? Bằng chứng hiện nay cho thấy, thay vì là một quá trình suy giảm dài và ổn định, chúng ta lão hóa một cách đáng kể vào khoảng ba thời điểm cụ thể trong đời. Liệu có thể duy trì sự trẻ trung lâu hơn không?
Ở tuổi khoảng 40, một người bạn của Maja Olecka đột nhiên nhận thấy mình không thể uống rượu như trước nữa. Lượng cồn mà trước đây cô ấy có thể bỏ qua một cách dễ dàng thì giờ đây lại khiến cô ấy "say bí tỉ". Tình trạng nôn nao (hangover)(1) sau đó trở nên tồi tệ hơn nhiều.
Bạn của Olecka chắc chắn không đơn độc – khi tôi ở độ tuổi đó, tôi cũng nghe những câu chuyện tương tự từ bạn bè, nhiều người trong số họ đã bỏ rượu. Nhưng Olecka, một nhà nghiên cứu tại Viện Lão hóa Leibniz – Viện Fritz Lipmann ở Jena, Đức, tin rằng cô ấy biết tại sao điều này xảy ra.
Ở tuổi này, cô ấy nói, nhiều người trải qua một quá trình lão hóa nhanh chóng, làm thay đổi khả năng chuyển hóa rượu của họ. Và thật không may, chuyện chưa hết ở đây. Sự lão hóa đột ngột này, được phản ánh qua những thay đổi phân tử đáng kể, đi kèm với sự tăng tốc suy giảm cơ bắp và da. Các tế bào miễn dịch chết đi nhanh chóng và có sự gia tăng đáng kể nguy cơ mắc bệnh tim mạch và tử vong. Nghiên cứu cũng cho thấy sự bùng phát lão hóa (rapid burst of aging) này lại xảy ra, vào khoảng tuổi 60 và 80.
Hóa ra, lão hóa có thể không phải là một sự trượt dốc đều đặn từ đỉnh cao của tuổi trẻ đến cái "après-ski" (nơi đến sau khi trượt tuyết) vĩnh cửu trên trời mà tất cả chúng ta vẫn nghĩ. "Nhiều định nghĩa đương thời về lão hóa mô tả nó là một quá trình tuyến tính (linear), dần dần," Olecka nói. "Chúng ta phải từ bỏ giả định này."
Thay vào đó, nó có thể giống như chèo thuyền vượt thác: những đoạn nước lặng dài xen kẽ bởi những thời kỳ nhiễu loạn cực độ đột ngột, đục những lỗ thủng trên chiếc bè của bạn cho đến khi bạn cuối cùng chìm xuống. Phát hiện đáng ngạc nhiên này vẫn còn ở giai đoạn đầu, nhưng nó có thể có những tác động sâu sắc – không chỉ đối với sự hiểu biết của chúng ta về lão hóa, mà còn đối với những nỗ lực làm chậm quá trình đó.
Các giai đoạn lão hóa
Những dấu hiệu đầu tiên cho thấy quá trình lão hóa diễn ra theo từng giai đoạn đến từ việc nghiên cứu các “Smurf” – không phải những nhân vật hoạt hình “xì trum” nhỏ, màu xanh lam, mà là những con ruồi giấm nhỏ, màu xanh lam.
Vào năm 2011, Michael Rera, khi đó đang làm việc tại Viện Nghiên cứu Y tế và Sức khỏe
Quốc gia Pháp ở Paris, đã phát hiện ra rằng ruồi thuộc loài Drosophila melanogaster bước vào một giai đoạn riêng biệt vào cuối đời tự nhiên của chúng. Cho ruồi ăn thuốc nhuộm màu xanh – ban đầu là một cách để đo lượng thức ăn chúng nạp vào – đã biến chúng thành màu xanh, do đó có tên "Smurf". Nhưng những con ruồi này chỉ trở nên xanh sau khi đạt đến một độ tuổi nhất định: ruồi giấm già có ruột bị rò rỉ, vì vậy khi chúng tiêu thụ thuốc nhuộm, nó sẽ thấm ra khoang cơ thể, biến chúng thành màu xanh.

Ruồi giấm ( fruit flies) lão hóa theo hai giai đoạn riêng biệt – bằng chứng là ruột đột nhiên bị rò rỉ, khiến thuốc nhuộm màu xanh từ thức ăn thấm vào khoang cơ thể. Ngay sau khi đạt đến trạng thái được gọi là “Smurf’ này, chúng sẽ chết.
Trạng thái nhuộm xanh này, và tính thấm của ruột gây ra nó, là một chỉ số đáng tin cậy cho thấy con ruồi sắp chết – và sẽ sớm chết. Những con ruồi bước vào trạng thái Smurf rất nhanh chóng: một ngày chúng vẫn bình thường, ngày hôm sau chúng chuyển sang màu xanh, và không lâu sau đó, chúng chết. Trạng thái Smurf cũng được đặc trưng bởi một số dấu hiệu cổ điển của sự suy yếu, bao gồm giảm hoạt động vận động tự phát (chúng ít di chuyển hơn) và dự trữ năng lượng. Điều này đã khiến Rera – hiện đang làm việc tại Viện Jacques Monod ở Paris – đề xuất rằng quá trình lão hóa của Drosophila là hai pha, diễn ra chậm rãi trong phần lớn cuộc đời trưởng thành của ruồi và sau đó đột ngột chuyển sang một trạng thái suy yếu sâu sắc hơn. Điều này có thể là do ruồi có thể chịu đựng sự tích tụ tổn thương phân tử trong một thời gian dài, nhưng sau đó đạt đến một ngưỡng mà chúng không thể chịu đựng được nữa.
Trạng thái Smurf kể từ đó đã được quan sát thấy ở các sinh vật khác, bao gồm giun tròn (nematode) và cá ngựa vằn, cho thấy tính thấm của ruột mà nó biểu thị là một đặc điểm chung của quá trình lão hóa.
May mắn thay, con người không chuyển sang màu xanh khi chúng ta gần cái chết hơn. Nhưng trong vài năm qua, bằng chứng đã tích lũy rằng chúng ta, giống như ruồi giấm, trải qua những sự leo thang nhanh chóng tương tự trong cách chúng ta lão hóa, có thể vì những lý do tương tự.
Ví dụ, vào năm 2022, một nhóm nghiên cứu tại Viện Wellcome Sanger ở Hinxton, Vương quốc Anh, đã phát hiện ra một chuyển đổi lớn và nhanh chóng trong khả năng tạo ra các tế bào máu mới vào khoảng tuổi 70. Cho đến thời điểm đó, hầu hết mọi người đều có một quần thể ổn định và mạnh mẽ gồm 20.000 đến 200.000 tế bào gốc tạo máu sản xuất ra các tế bào hồng cầu, bạch cầu và tiểu cầu mới. Nhưng sau tuổi 70, số lượng này giảm mạnh, đến mức phần lớn các tế bào máu mới được tạo ra chỉ bởi hàng trăm hoặc thậm chí hàng chục tế bào gốc. Điều này làm tăng đáng kể nguy cơ thiếu máu và các tình trạng khác đặc trưng bởi sự giảm tế bào máu, cùng với rối loạn chức năng hệ miễn dịch, tái tạo mô kém và ung thư máu – tất cả đều làm tăng nguy cơ tử vong và đã được biết là đột ngột tăng vọt ở những người trên 70 tuổi.
Nguyên nhân của sự sụp đổ đột ngột này dường như là do hầu hết các tế bào gốc tạo máu này cuối cùng đã chịu thua trước những tổn thương phân tử đã tích lũy trong suốt vòng đời của chúng. Theo Steve Hoffmann, đồng nghiệp của Olecka tại Viện Lão hóa Leibniz, đây là một điểm bùng phát kinh điển, khi một hệ thống trải qua một sự thay đổi đột ngột từ trạng thái cân bằng này sang trạng thái khác, thường là không thể đảo ngược, sau một quá trình tích lũy áp lực chậm và dài.
Khái niệm này quen thuộc trong vật lý, sinh thái học và khoa học khí hậu, nhưng Olecka và Hoffmann muốn áp dụng nó vào nghiên cứu lão hóa – một cách cẩn thận. "Đó là một thuật ngữ khó vì không có định nghĩa khoa học nghiêm ngặt về điểm bùng phát và các lĩnh vực khác nhau sử dụng nó theo những cách khác nhau," Olecka nói. "Nhưng tôi nghĩ đó là một thuật ngữ rất tốt để truyền đạt khái niệm chung về sự thay đổi đột ngột sau khi vượt qua một ngưỡng nào đó."
Ý tưởng của Olecka và Hoffmann dựa trên bằng chứng ngày càng tăng cho thấy, ở nhiều khu vực và hệ thống trong cơ thể, các quá trình lão hóa được khuếch đại sau khi các giới hạn sinh học quan trọng bị vi phạm. Các nhà nghiên cứu đã phát hiện ra các điểm bùng phát khác như vậy, nhiều trong số đó ở cùng độ tuổi. Ví dụ, vào cuối những năm 2010, một nhóm do Tony Wyss-Coray tại Đại học Stanford ở California dẫn đầu đã quan tâm đến phương pháp nối mạch dị thời (heterochronic parabiosis), một thủ thuật kinh khủng trong đó hệ tuần hoàn của hai động vật được phẫu thuật nối với nhau. Trong một nghiên cứu năm 2011, Wyss-Coray và các đồng nghiệp của ông đã nối hệ tuần hoàn của một con chuột già và một con chuột non, phát hiện ra rằng thủ thuật này làm trẻ hóa con chuột già và làm lão hóa con chuột non. Phát hiện của họ cho thấy rằng máu – hay, cụ thể hơn là phần chất lỏng của nó, huyết tương – chứa các yếu tố điều hòa quan trọng của quá trình lão hóa.
Để xem những yếu tố đó có thể là gì, ông và các đồng nghiệp đã theo dõi cách các protein trong huyết tương thay đổi trong suốt quá trình lão hóa của con người. Trong một nghiên cứu được công bố vào năm 2019, họ đã lấy máu từ 4263 người trong độ tuổi từ 18 đến 95 và đo mức độ của 2925 protein trong huyết tương. Họ dự kiến sẽ thấy những thay đổi dần dần, tuyến tính theo tuổi tăng lên, nhưng họ đã không thấy.
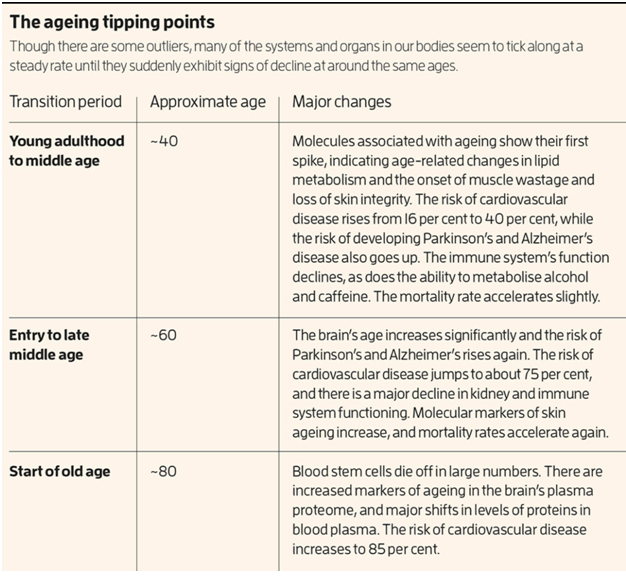
Trước sự ngạc nhiên của họ, họ phát hiện ra rằng những người tham gia được nhóm thành bốn nhóm: dưới 34 tuổi, 34 đến 60 tuổi, 61 đến 78 tuổi và trên 78 tuổi. Trong mỗi nhóm, hồ sơ protein rất giống nhau, nhưng ở các độ tuổi 34, 60 và 78, chúng đột ngột thay đổi, với mức độ của một số protein tăng lên đáng kể trong khi những protein khác giảm mạnh. Hơn nữa, một số protein trở nên phong phú hơn ở các nhóm tuổi lớn hơn đã được biết là có liên quan đến bệnh tim mạch và bệnh Alzheimer. Các nhà nghiên cứu cũng tìm thấy sự phong phú của một protein liên quan đến hội chứng Down. Không ai trong số những người tham gia bị Down, nhưng một hậu quả của hội chứng này là lão hóa nhanh. Kết luận của họ là con người dường như trải qua ba đợt lão hóa nhanh chóng vào khoảng 34, 60 và 78 tuổi.
Trong một nghiên cứu sâu hơn, một nhóm do Michael Snyder tại Đại học Stanford dẫn đầu đã xem xét RNA, chất chuyển hóa, lipid và các phân tử gây viêm cũng như protein huyết tương ở 108 người trong độ tuổi từ 25 đến 75. Các nhà nghiên cứu phát hiện ra rằng các phân tử đã được biết là các dấu hiệu của lão hóa tăng đột biến đáng kể trong hai khoảng thời gian ngắn, lần đầu tiên vào đầu đến giữa những năm 40 và sau đó vào khoảng 60 tuổi. Cả hai đợt tăng đột biến đều bao gồm các phân tử liên quan đến tăng nguy cơ mắc bệnh tim mạch, rối loạn chuyển hóa lipid (có thể gây tích tụ chất béo hoặc chất giống chất béo có hại trong tế bào và mô), giảm ổn định cơ bắp và suy giảm tính toàn vẹn của da, khiến da dễ bị tổn thương và nhiễm trùng hơn. Nhưng cả hai cũng có những đặc điểm riêng. Đợt tăng đột biến đầu tiên đi kèm với sự suy giảm khả năng chuyển hóa caffeine và rượu một cách hiệu quả, giải thích vấn đề nôn nao ở tuổi trung niên. Đợt tăng đột biến thứ hai gợi ý sự suy giảm đáng kể chức năng thận và hệ miễn dịch."
Những gì chúng tôi phát hiện ra là hầu hết mọi thứ không thay đổi theo tuyến tính ( linear)," Snyder nói. Chỉ 6,6% trong số hàng ngàn phân tử được theo dõi thay đổi theo tuổi; 81% thay đổi không tuyến tính. Thực tế là thời gian của các đợt tăng đột biến tương ứng gần đúng với hai đợt đầu tiên được nhóm của Wyss-Coray thấy ở tuổi 34 và 60 cho thấy rằng chúng đang thu nhận cùng một tín hiệu, ông nói. Nhóm của ông không thể xem liệu có một đợt tăng đột biến ở tuổi 78 hay không vì những đối tượng lớn tuổi nhất của họ chỉ mới 75 tuổi.
Có những dấu hiệu cho thấy các cơ quan và hệ thống riêng lẻ cũng lão hóa theo từng giai đoạn. Ví dụ, vào năm 2020, các nhà nghiên cứu ở Đức đã lập hồ sơ phân tử của các mẫu da lấy từ phụ nữ trong độ tuổi từ 21 đến 76. Họ phát hiện ra, không ngạc nhiên, rằng da của phụ nữ lớn tuổi có nhiều dấu hiệu lão hóa phân tử hơn. Nhưng hành trình từ da trẻ đến da già là một hành trình nhăn nheo, với các điểm bùng phát vào khoảng 30, 50 và 65 tuổi, phân chia quá trình lão hóa da thành bốn giai đoạn riêng biệt. Các điểm bùng phát đã được phát hiện trong hệ protein huyết tương của não, tập hợp các protein được tìm thấy trong huyết tương máu, ở tuổi 57, 70 và 78, trùng với sự gia tăng các dấu hiệu sinh học của lão hóa. Và một số tế bào miễn dịch quan trọng, bao gồm tế bào B, tế bào T và tế bào tiêu diệt tự nhiên, trải qua hai đợt suy giảm và lão hóa vào khoảng tuổi 40 và 65, có thể góp phần vào sự suy yếu chức năng miễn dịch, một dấu hiệu của lão hóa.
Các điểm bùng phát cũng có thể là nền tảng cho một số mô hình khó hiểu cho đến nay trong sự xuất hiện của các bệnh liên quan đến tuổi tác và tử vong. Theo Snyder, chúng ta đã biết rằng tỷ lệ mắc một số bệnh liên quan đến tuổi tác cho thấy sự thay đổi bước. Ví dụ, nguy cơ mắc bệnh tim mạch tăng từ 16% lên 40% ở tuổi 40, sau đó duy trì gần như ổn định cho đến tuổi 59. Nguy cơ sau đó nhảy vọt lên khoảng 75% ở tuổi 60, và một lần nữa lên khoảng 85% sau 80 tuổi.
Tương tự, tỷ lệ mắc các bệnh thoái hóa thần kinh Parkinson và Alzheimer tăng tốc nhẹ hơn vào khoảng 40 tuổi và sau đó tăng mạnh hơn vào khoảng 65 tuổi.
Dữ liệu về tử vong cũng cho thấy những điểm không tuyến tính (non linear) tinh tế. Giả định lâu nay là tỷ lệ tử vong tăng đều đặn và theo cấp số nhân trong suốt tuổi trưởng thành, sao cho nguy cơ tử vong do bất kỳ nguyên nhân nào tăng gấp đôi cứ sau khoảng tám năm. Nhưng khi Aleksei Golubev tại Trung tâm Nghiên cứu Y tế Quốc gia N. N. Petrov về Ung thư học ở Saint Petersburg, Nga, xem xét kỹ dữ liệu từ Pháp, Thụy Điển và Nhật Bản, ông bất ngờ phát hiện ba giai đoạn mà tỷ lệ tử vong tăng tốc nhẹ nhưng có thể nhận thấy – vào khoảng tuổi 17, 38 và 60. Đầu tiên trong số này có thể là do các yếu tố bên ngoài như tai nạn, theo Hoffmann, nhưng điều thú vị là hai giai đoạn còn lại trùng với các điểm bùng phát phân tử. Do đó, chúng có thể một phần là do quá trình lão hóa nhanh hơn vào những thời điểm đó.
Điều gì gây ra một điểm bùng phát?
Nếu bạn tổng hợp tất cả các điểm bùng phát lão hóa – có tính đến một số ngoại lệ, chẳng hạn như lão hóa da – thì dường như một khi chúng ta trưởng thành, cuộc đời chúng ta được chia thành các giai đoạn kéo dài khoảng 20 năm. "Tôi nghĩ chúng ta cần thêm dữ liệu, nhưng từ những gì tôi thấy, những chuyển đổi quan trọng nhất ở con người là vào khoảng 40 tuổi, khoảng 60 tuổi và sau đó là khoảng 80 tuổi," Olecka nói.
Bạn có thể nói rằng chúng ta biết điều đó một cách trực giác – chúng ta thường gọi các giai đoạn này là tuổi trưởng thành trẻ, tuổi trung niên sớm, tuổi trung niên muộn và tuổi già (xem The ageing tipping points/"Các điểm bùng phát lão hóa", trên đây). Nhưng nghiên cứu cho chúng ta biết rằng những nhãn (label) không chính thức này là những giai đoạn cuộc đời thực sự với những đặc điểm sinh học riêng biệt.
Vậy, điều gì thúc đẩy những thay đổi đột ngột này? Theo Olecka và Hoffmann, có lẽ đó là tổn thương phân tử tích lũy cuối cùng đã áp đảo khả năng đối phó của cơ thể, không khác gì những gì xảy ra với ruồi giấm. Hệ thống sửa chữa tự nhiên của chúng ta có thể làm giảm bớt những thay đổi phân tử này đến một mức độ nào đó, nhưng sau đó trở nên quá tải hoặc kiệt sức, khiến hệ thống rơi vào trạng thái mới. Điều này hiện tại vẫn còn là giả thuyết, nhưng một số bộ đệm ( buffers) có thể là sửa chữa DNA (các quá trình tế bào xác định tổn thương phân tử DNA và sửa chữa chúng), chất chống oxy hóa và các “giám thị” phân tử ( molecular “chaperone”) đảm bảo sự cuộn gấp (folding) đúng của protein (2). Cũng có thể có hiệu ứng domino, trong đó việc vượt qua một điểm bùng phát sẽ đẩy một điểm khác vượt qua ngưỡng, họ nói.Snyder nghi ngờ rằng sự chuyển đổi khoảng 40 tuổi một phần là do thay đổi lối sống. "Tôi đoán là mọi người không tập thể dục nhiều, họ trở nên ít vận động hơn và họ có lẽ không ăn uống tốt," ông nói, "và điều đó sẽ đuổi kịp họ khi họ bước vào đầu những năm 40 tuổi."
Điều đó mang lại triển vọng trì hoãn sự xuất hiện của các điểm bùng phát bằng chế độ ăn uống, tập thể dục và, có thể một ngày nào đó, một loại dược phẩm mới được gọi tạm thời là "chất chống chuyển đổi". Mặc dù không phải tất cả các quá trình lão hóa đều tuân theo động lực không tuyến tính – tích lũy đột biến, ví dụ, là tuyến tính (3) – Hoffmann lưu ý rằng "những chuyển đổi không tuyến tính này đặc biệt thú vị". Khám phá chúng có thể mở ra những mục tiêu mới cho các liệu pháp chống lão hóa."
Hiện tại, mọi người đang tìm kiếm thuốc chống lão hóa có thể hiệu quả cho tất cả mọi người, nhưng có lẽ chúng ta nên tìm kiếm các chiến lược để ngừng hoặc trì hoãn các chuyển đổi," Olecka nói. "Đây có thể là một phương pháp thành công hơn và có mục tiêu hơn." Những loại thuốc như vậy còn xa vời, nhưng các bước đã được thực hiện dưới dạng các can thiệp di truyền mà nhóm của Rera đã thiết kế để trì hoãn việc ruồi giấm bước vào trạng thái Smurf.
Trong khi đó, Olecka và Hoffmann hình dung việc chuyển đổi nghiên cứu cơ bản thành một hệ thống phân tầng cho lão hóa, theo đó mọi người được xếp vào một trong bốn, hoặc thậm chí năm hoặc sáu giai đoạn và được điều trị tương ứng. "Chúng tôi nghĩ rằng các chuyển đổi có thể đánh dấu ranh giới tự nhiên giữa các giai đoạn lão hóa và hữu ích cho việc phòng ngừa," Olecka nói. "Một số can thiệp có thể có lợi ở giai đoạn trẻ hơn, nhưng lại có hại ở giai đoạn lớn tuổi hơn." Tuy nhiên, những chi tiết cụ thể vẫn đang chờ được khám phá.
Vậy một khi Rubicon (4) đã bị vượt qua – sau khi một giai đoạn tuổi tác đã đạt được – liệu có thể quay lại không? "Đây là một câu hỏi rất, rất quan trọng cần trả lời," Olecka nói. "Chúng tôi chưa biết."
Nhưng chúng ta có thể sớm biết. Snyder, ví dụ, đang xử lý dữ liệu từ một nhóm người lớn hơn mà ông đã theo dõi trong 12 năm. Một trong những mục tiêu của ông là tìm ra những can thiệp nào có thể trì hoãn các điểm bùng phát. "Bằng cách theo dõi lối sống của mọi người, chúng tôi sẽ hiểu rõ hơn liệu một số người có thể đẩy những thay đổi này sang tuổi 50 hoặc muộn hơn hay không," ông nói. "Và nếu vậy, họ đã làm gì để điều đó xảy ra?"
Với sự tích lũy của những bằng chứng thuyết phục như vậy và những nghiên cứu mới đang được tiến hành, như Hoffmann nói, lĩnh vực nghiên cứu lão hóa có thể tự nó đang tiến đến một điểm bùng phát.
Chú thích:
1) Hangover: "Nôn nao" là một loạt các triệu chứng khó chịu về thể chất và tinh thần xảy ra sau khi uống quá nhiều rượu. Các triệu chứng thường gặp bao gồm đau đầu, mệt mỏi, buồn nôn, nhạy cảm với ánh sáng và âm thanh, và rối loạn tâm trạng như lo lắng và cáu kỉnh. Những triệu chứng này phát sinh từ nhiều yếu tố liên quan đến quá trình chuyển hóa rượu và tác động của nó lên cơ thể.
2)Chaperone ( giám thị) phân tử là protein giúp các protein khác gấp cuộn, cuộn xếp (folding) vào cấu hình hoạt động hoặc duỗi mở (unfolding) khi cần thiết, đảm bảo chúng có cấu trúc và chức năng chính xác, đồng thời ngăn ngừa kết tụ bất thường, đặc biệt khi tế bào chịu stress.
Giải thích vai trò folding & unfolding:
• “Protein folding” là quá trình một chuỗi polypeptide tự gấp lại thành cấu trúc không gian ba chiều đặc hiệu, giúp protein thực hiện đúng chức năng sinh học. Nếu folding sai, protein dễ mất chức năng hoặc tạo kết tụ gây bệnh.
• “Unfolding” là quá trình duỗi mở lại cấu trúc (do stress, sốc nhiệt hoặc cần chuyển hóa), giúp tế bào xử lý, chuyển vị trí hoặc loại bỏ protein đó, hay cho phép protein “refold” lại sau khi stress kết thúc
3) Nguyên văn tiếng Anh: “mutation accumulation is linear”:
Cụm từ "tích lũy đột biến là tuyến tính" (mutation accumulation is linear) trong ngữ cảnh lão hóa và di truyền học có nghĩa là:
Sự tích lũy các đột biến (những thay đổi trong vật liệu di truyền của tế bào, tức DNA) diễn ra theo một tỷ lệ tương đối ổn định và đều đặn theo thời gian, gần như là một đường thẳng. Điều này có nghĩa là số lượng đột biến mới xuất hiện và tích lũy trong cơ thể chúng ta sẽ tăng lên một cách đều đặn qua mỗi đơn vị thời gian (ví dụ, mỗi năm hoặc mỗi thế hệ tế bào), không tăng đột ngột hay giảm mạnh một cách bất thường.
Đây là một khái niệm quan trọng trong các lý thuyết về lão hóa, đặc biệt là Lý thuyết tích lũy đột biến của Medawar, cho rằng các đột biến có hại, đặc biệt là những đột biến chỉ biểu hiện tác động tiêu cực vào cuối đời (sau khi sinh sản), ít bị đào thải bởi chọn lọc tự nhiên hơn và do đó có xu hướng tích lũy trong bộ gen theo thời gian, góp phần vào quá trình lão hóa.
4)Rubicon” trong tiếng Việt thường được dịch là “bước quyết định” hoặc “điểm không thể quay lại”. Ý nghĩa này xuất phát từ một sự kiện lịch sử: vào năm 49 trước Công nguyên, tướng Julius Caesar đã dẫn quân vượt sông Rubicon (một con sông nhỏ ở Bắc Ý, ranh giới của lãnh thổ La Mã). Luật La Mã khi đó cấm các tướng quân đưa quân đội vào Ý, nên việc vượt qua sông Rubicon đồng nghĩa với việc công khai nổi loạn chống lại chính quyền và không còn đường lui nữa.
BS Hồ văn Hiền phỏng dịch, tóm tắt và chú thích
Nguyên tác: “Rapid bursts of ageing are causing a total rethink of how we grow old”, by Graham Lawton
https://apple.news/AfKYovvvtTF2F4Yq0IMimeg
5/31/2025



















